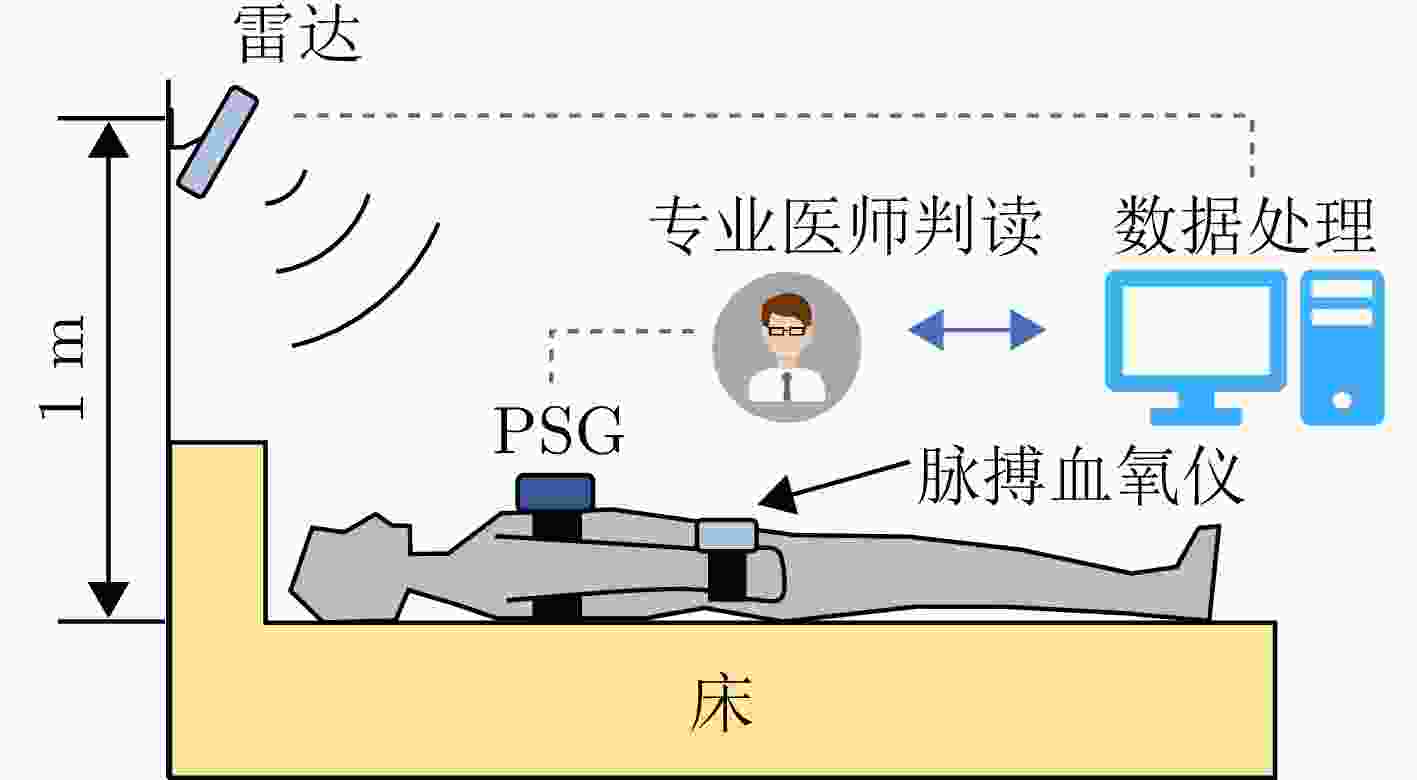
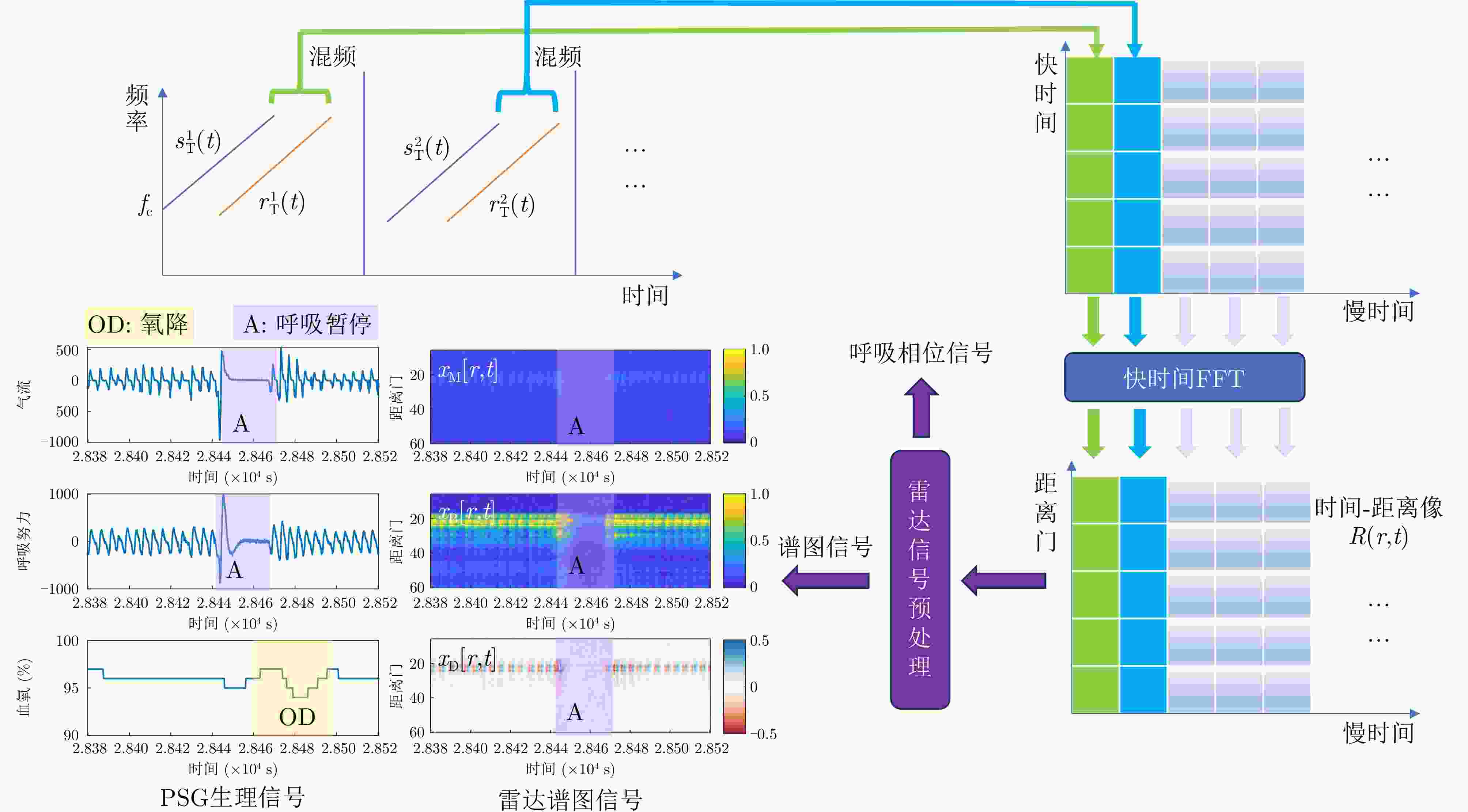
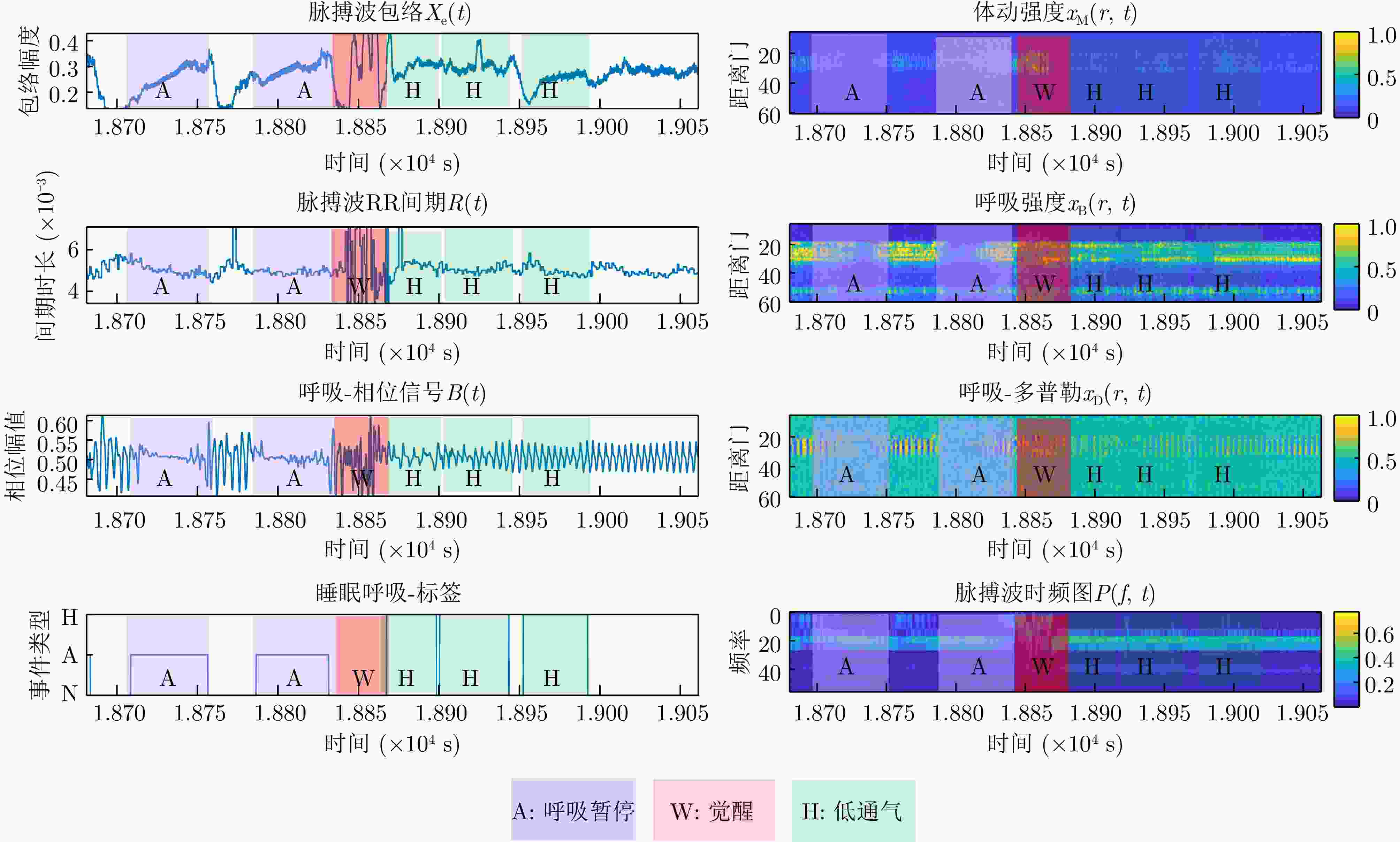
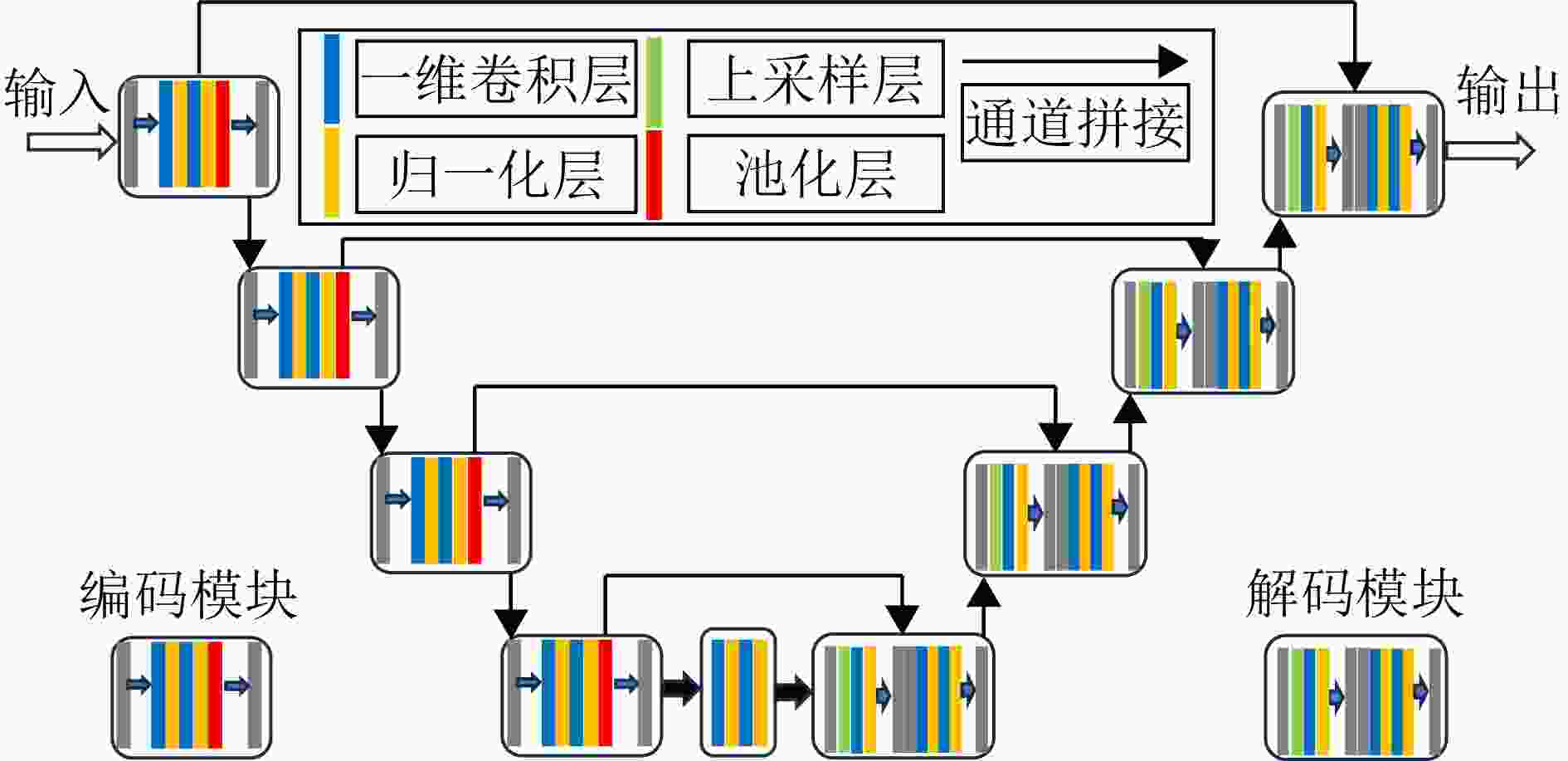
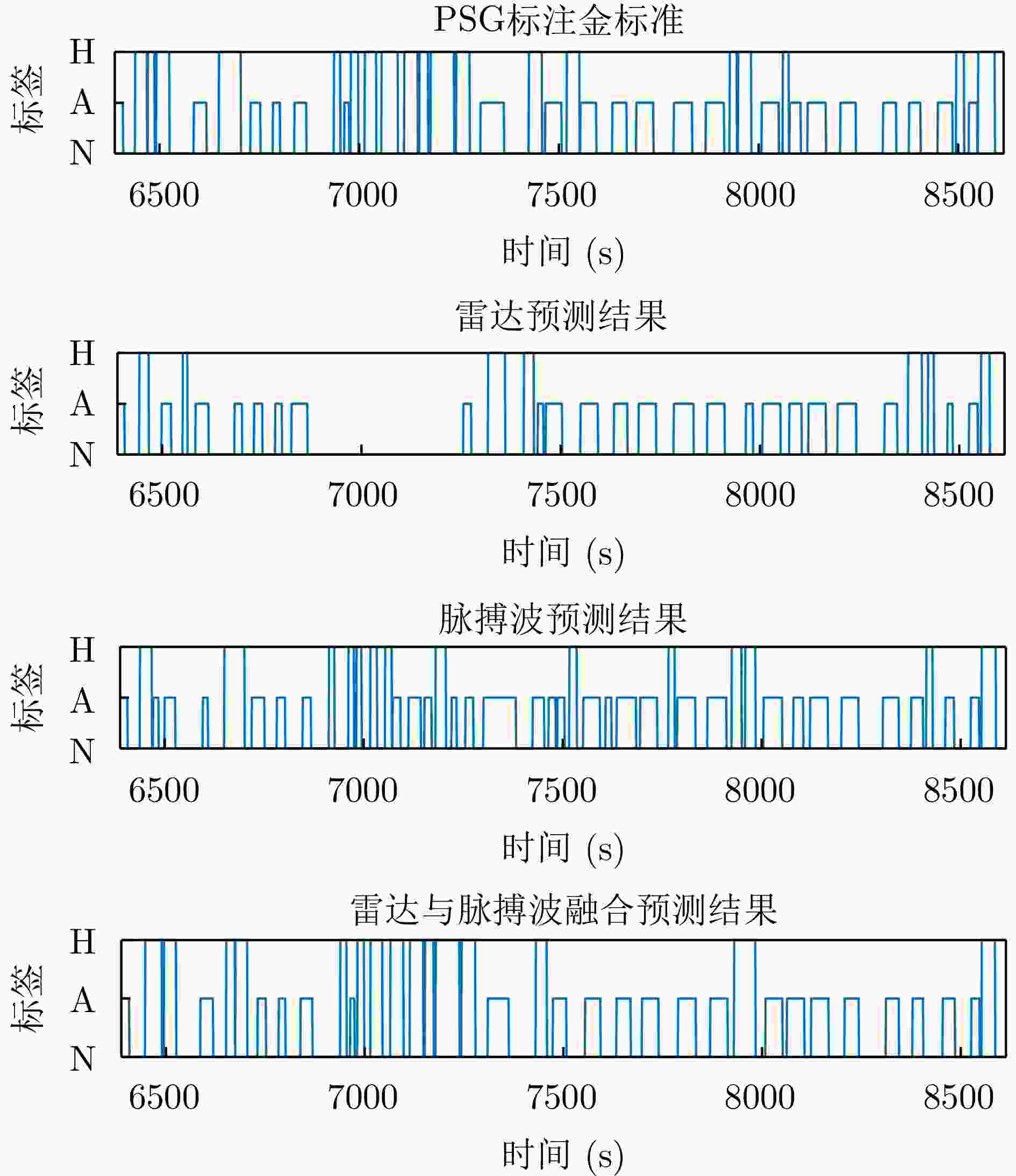
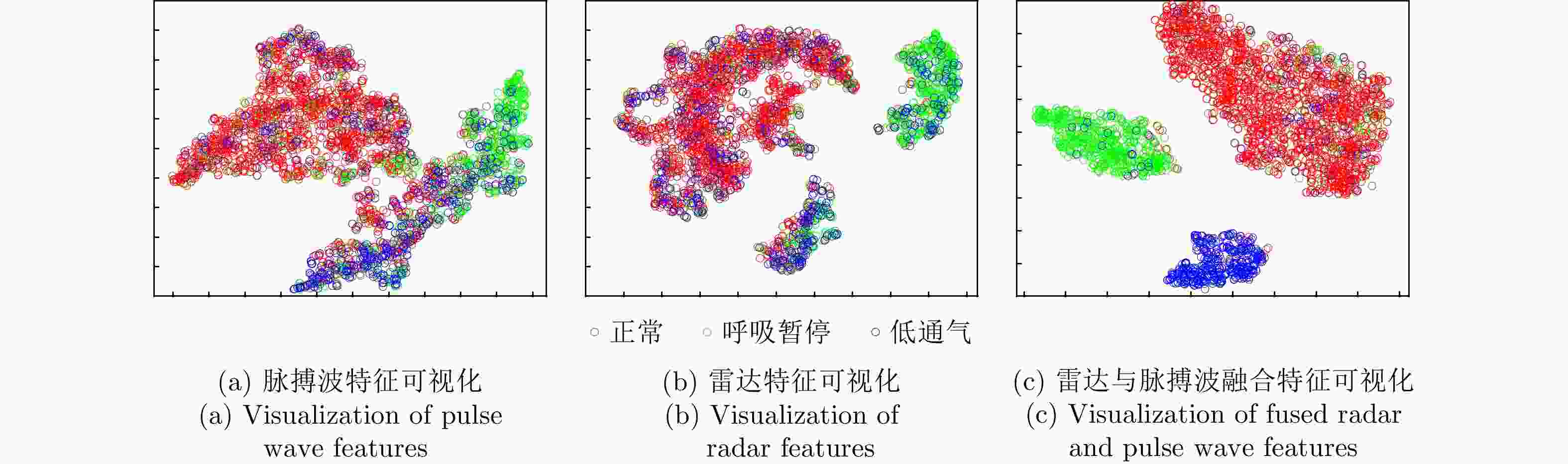
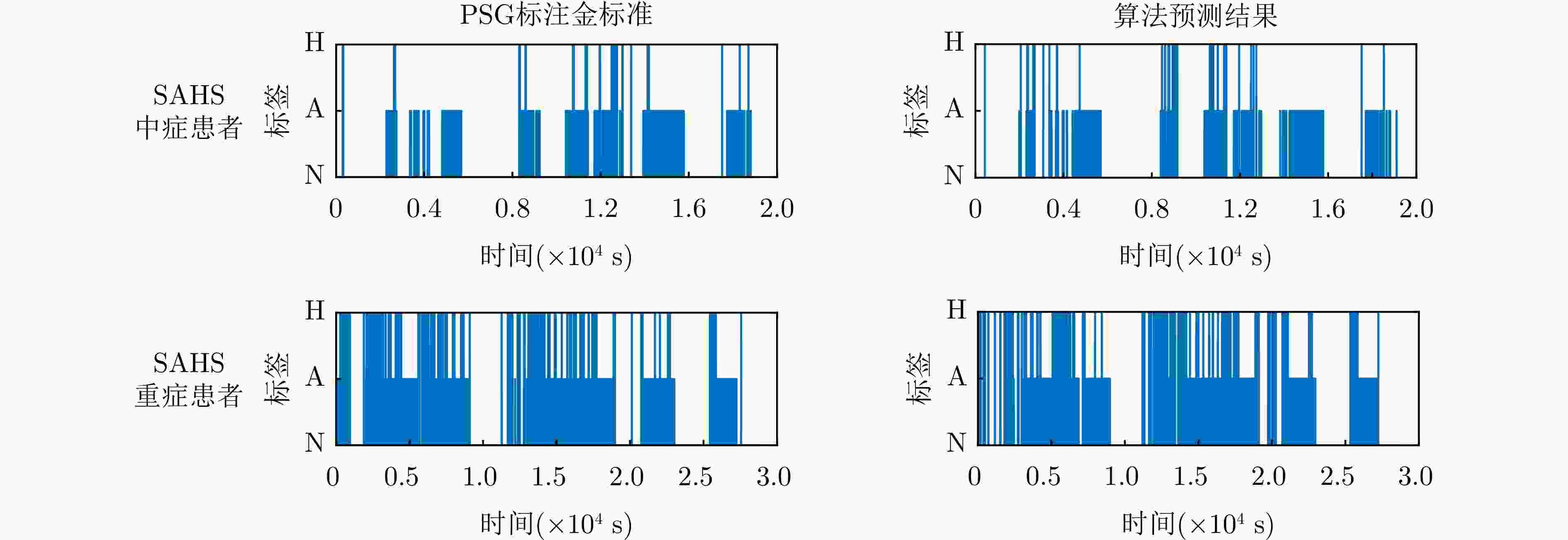
Diagnosis of Sleep Apnea Hypopnea Syndrome Using Fusion of Micro-motion Signals from Millimeter-wave Radar and Pulse Wave Data
-
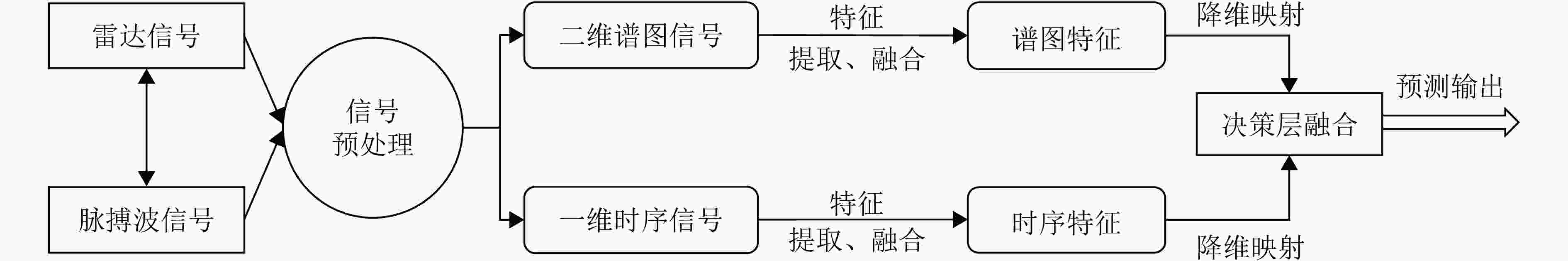
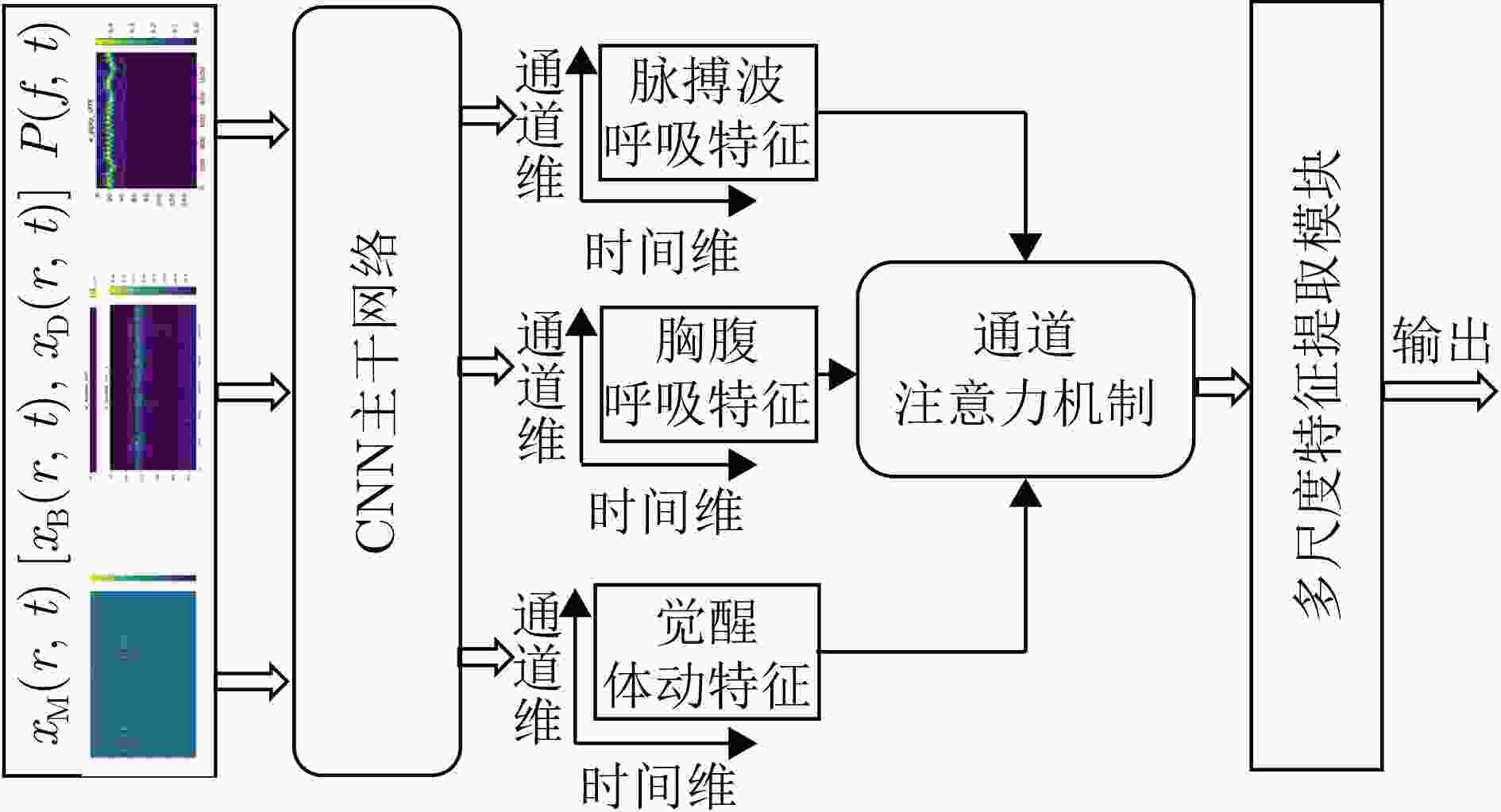
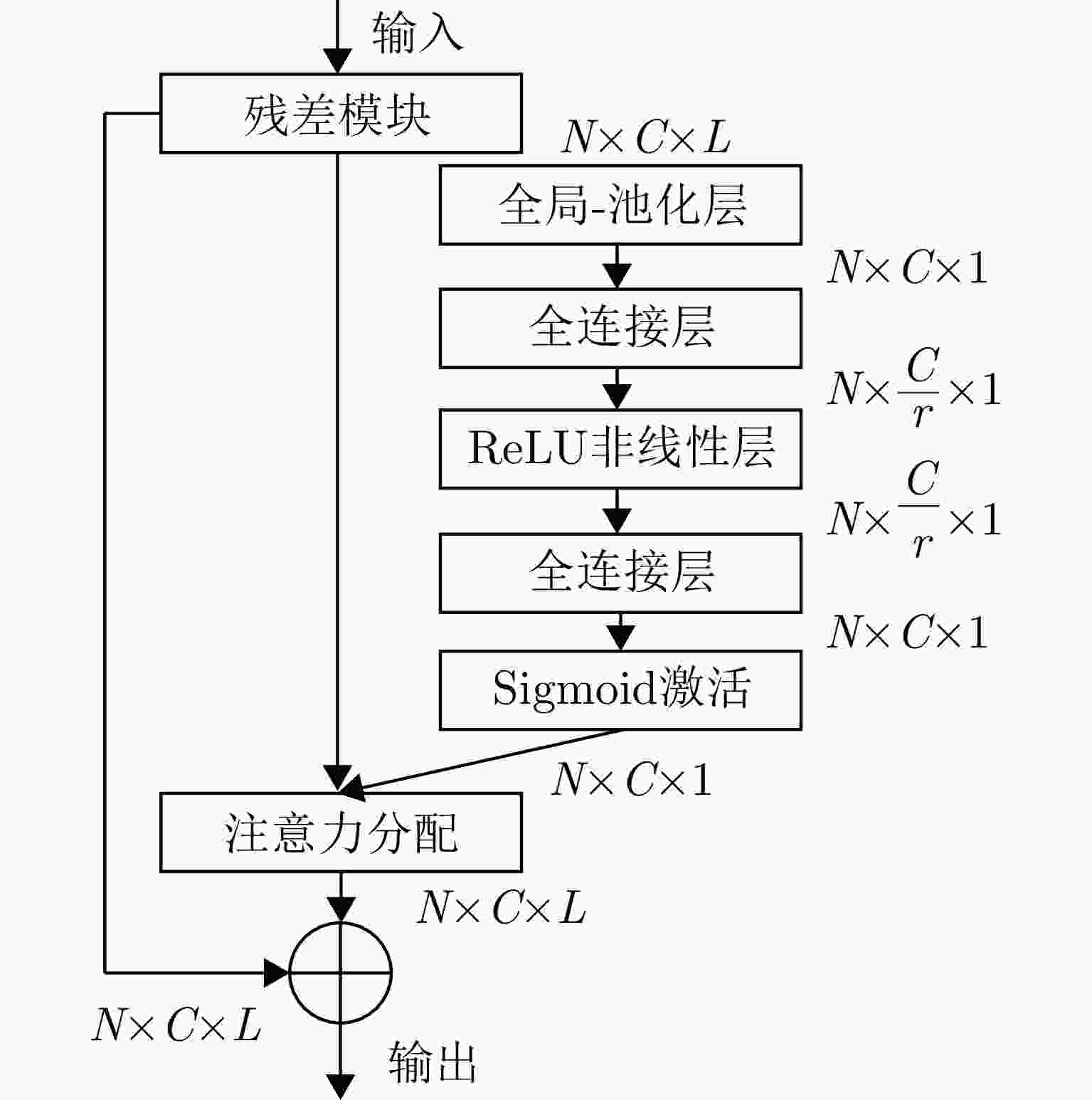
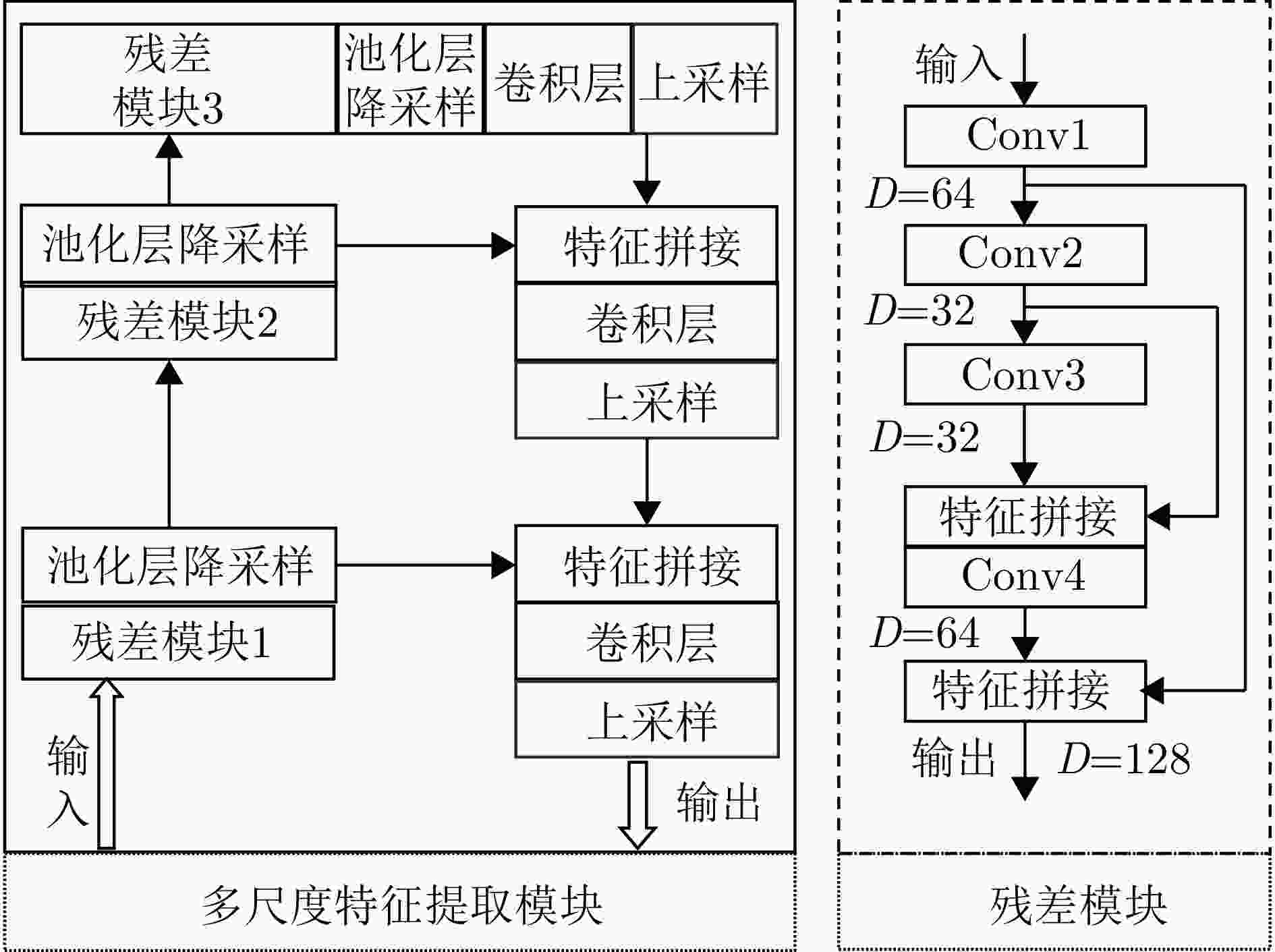
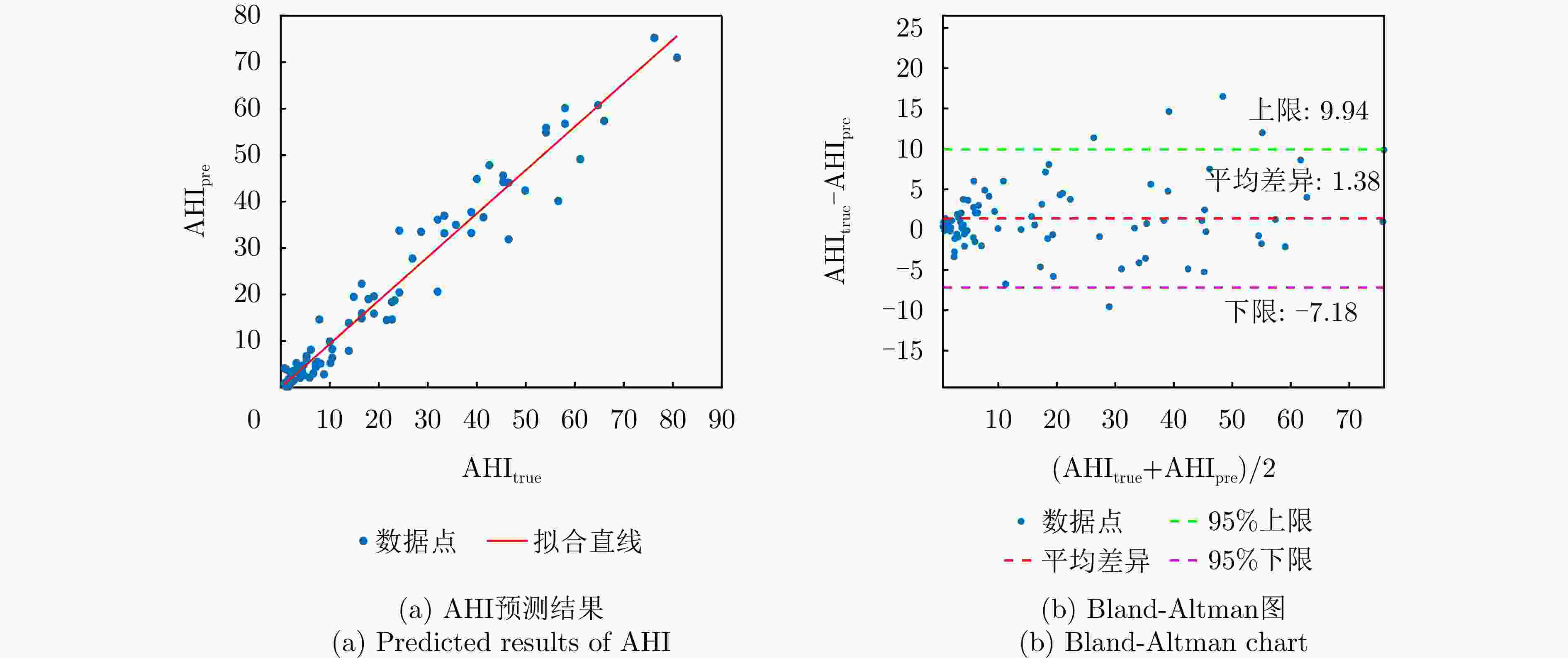
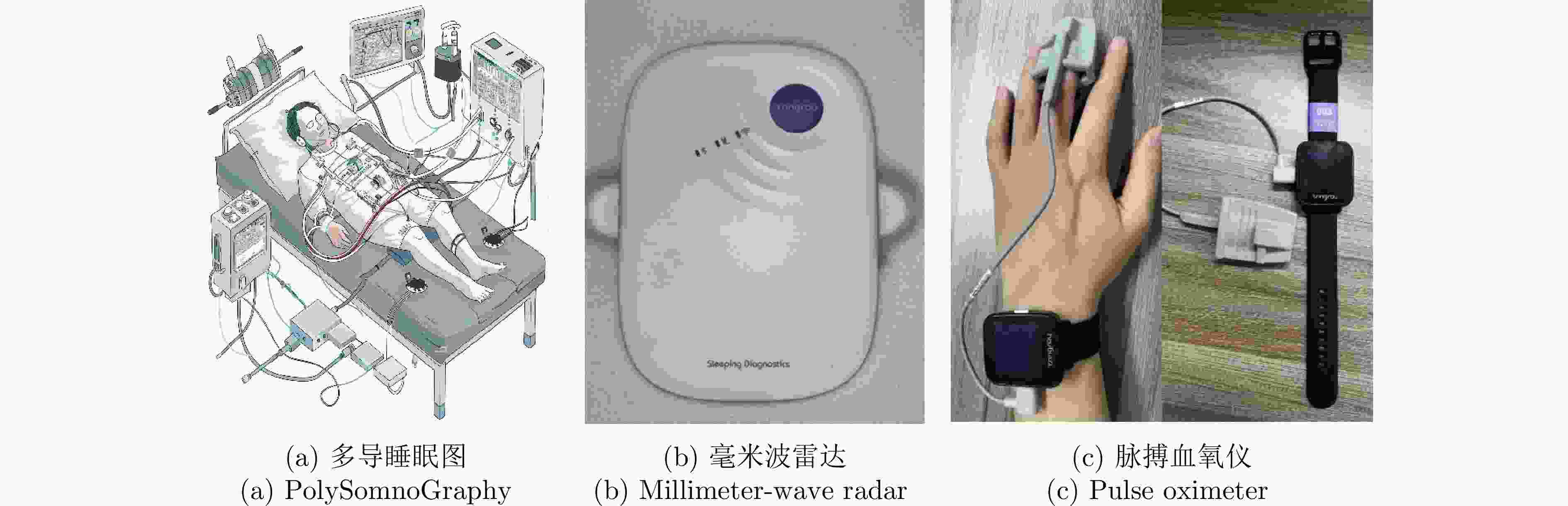
摘要: 睡眠呼吸暂停低通气综合征(SAHS)是一种常见的慢性睡眠呼吸障碍疾病,严重影响患者的睡眠质量和身体健康。该文提出了一种基于多源信号融合的睡眠呼吸暂停与低通气检测框架,通过融合毫米波雷达微动信号与光电容积脉搏波(PPG)描记法的脉搏波数据,实现高可靠的轻接触式睡眠呼吸暂停低通气综合征的诊断,以解决传统医学上依赖多导睡眠图(PSG)进行睡眠监测时舒适度差、成本高等缺点。研究中,为兼顾睡眠呼吸异常事件检测的准确率和鲁棒性,该文提出了一种雷达、脉搏波数据预处理算法得到信号中的时频信息和人工特征,并设计了用于将两类信号融合的深度神经网络,以实现对睡眠呼吸暂停和低通气事件的精准识别,从而估算呼吸暂停低通气指数(AHI),用于对患者的睡眠呼吸异常严重程度进行定量评估。基于上海交通大学医学院附属第六人民医院临床试验数据集的实验结果表明,该文所提方案估算的AHI与金标准PSG的相关系数达到了0.93,一致性良好,有潜力普及成为家用睡眠呼吸监护的工具,并起到睡眠呼吸暂停低通气综合征初步筛查的作用。Abstract: Sleep Apnea Hypopnea Syndrome (SAHS) is a common chronic sleep-related breathing disorder that affects individuals’ sleep quality and physical health. This article presents a sleep apnea and hypopnea detection framework based on multisource signal fusion. Integrating millimeter-wave radar micro-motion signals and pulse wave signals of PhotoPlethysmoGraphy (PPG) achieves a highly reliable and light-contact diagnosis of SAHS, addressing the drawbacks of traditional medical methods that rely on PolySomnoGraphy (PSG) for sleep monitoring, such as poor comfort and high costs. This study used a radar and pulse wave data preprocessing algorithm to extract time-frequency information and artificial features from the signals, balancing the accuracy and robustness of sleep-breathing abnormality event detection Additionally, a deep neural network was designed to fuse the two types of signals for precise identification of sleep apnea and hypopnea events, and to estimate the Apnea-Hypopnea Index (AHI) for quantitative assessment of sleep-breathing abnormality severity. Experimental results of a clinical trial dataset at Shanghai Jiaotong University School of Medicine Affiliated Sixth People’s Hospital demonstrated that the AHI estimated by the proposed approach correlates with the gold standard PSG with a coefficient of 0.93, indicating good consistency. This approach is a promiseing tool for home sleep-breathing monitoring and preliminary diagnosis of SAHS.
-
表 1 FMCW雷达基本参数
Table 1. Basic parameters of FMCW radar
参数 数值 起始频率$ {f_{\text{c}}} $ $ 60{\text{ GHz}} $ 线性调频带宽B $ {\text{3 GHz}} $ 扫频周期T $ {\text{2 ms}} $ 快时间实际采样点数N $ 256 $ 快时间采样频率$ {f_{\text{s}}} $ $ 1000{\text{ kHz}} $ 距离分辨率$ \Delta R $ $ {\text{5 cm}} $ 表 2 脉搏血氧仪基本参数
Table 2. Basic parameters of the pulse oximeter
参数 数值 红光波长 $ 660 \pm {\text{3 nm}} $ 红外光波长 $ {\text{905}} \pm {\text{10 nm}} $ 红光辐射功率 $ {\text{3}}{\text{.2}} \times 1{{\text{0}}^{{{ - 3}}}}{\text{ W}} $ 红外光辐射功率 $ {\text{2}}{\text{.4}} \times 1{{\text{0}}^{{{ - 3}}}}{\text{ W}} $ 采样频率 $ {\text{128 Hz}} $ 1 脉搏波间期提取算法
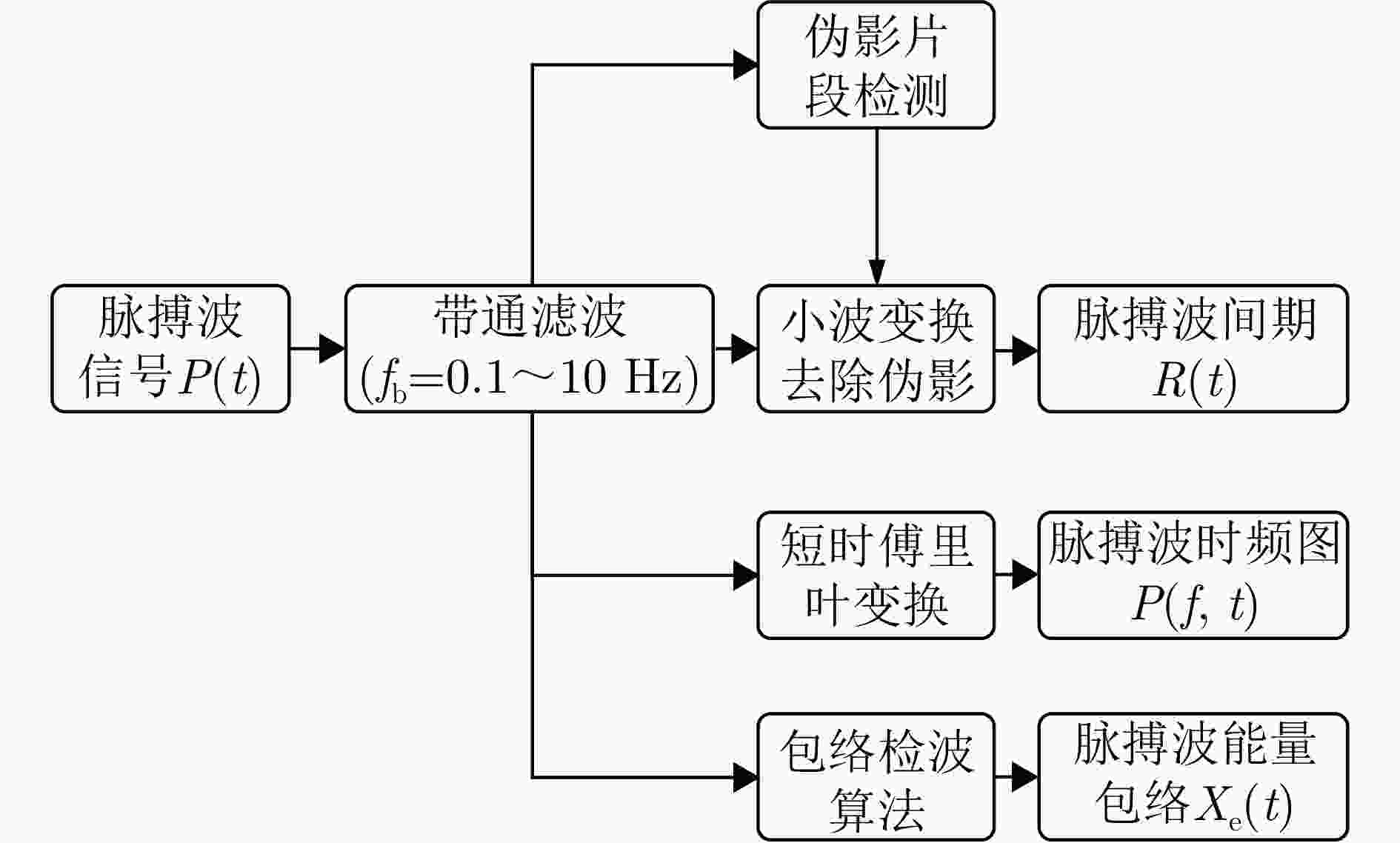
1. Pulse wave interval extraction algorithm
输入:脉搏波滤波信号$ {P_{\text{B}}}(t) $
输出:脉搏波间期$ R(t) $1.将信号取平方,得到对应点的能量信号$ {P_{\text{w}}}(t) $ 2.以脉搏波收缩波的平均持续时间$ {T_1} $为滑窗长度,对信号进行平
滑以凸显收缩波,得到信号$ {x_{{\text{peak}}}}(t) $。3.以脉搏波的平均持续时间$ {T_2} $为滑窗长度,对信号进行平滑以压
缩舒张波,得到信号$ {x_{{\text{beat}}}}(t) $。4.利用信号$ {x_{{\text{beat}}}}(t) $与能量信号$ {P_{\text{w}}}(t) $加权求和得各个时刻阈值
$ {x_{{\text{thr}}}}(t) $。5.比较信号$ {x_{{\text{peak}}}}(t) $和阈值$ {x_{{\text{thr}}}}(t) $,定位收缩波。 6.寻找收缩波时间段内的最大极值点作为收缩波的峰值点,从
而确定脉搏间期$ R(t) $。表 3 时序信号与谱图信号对比实验
Table 3. Comparison experiment between time-domain signals and spectrogram signals
信号 N A H pre rec F1 pre rec F1 pre rec F1 时序信号 0.859 0.975 0.913 0.863 0.508 0.639 0.616 0.361 0.455 谱图信号 0.928 0.945 0.936 0.731 0.848 0.785 0.558 0.586 0.572 时序信号+谱图信号 0.961 0.934 0.947 0.751 0.895 0.817 0.627 0.650 0.638 注:加粗项表示最优结果。 表 4 雷达与脉搏波对比实验
Table 4. Comparison experiment between radar signals and pulse wave signals
传感器 N A H pre rec F1 pre rec F1 pre rec F1 PPG 0.834 0.971 0.897 0.816 0.681 0.742 0.652 0.462 0.541 Radar 0.909 0.902 0.906 0.714 0.826 0.766 0.506 0.549 0.527 PPG+Radar 0.961 0.934 0.947 0.751 0.895 0.817 0.627 0.650 0.638 注:加粗项表示最优结果。 表 5 现有研究结果性能比较
Table 5. Comparative performance with existing research findings
方法 数据集人数 传感器 呼吸监测仪 Bland-Altman 线性拟合系数R Kang, 2020[18] (CFAR) 94 (23, 24, 14, 33) 6.5~8.0 GHz UWB PSG –2.8 (–21.7, +16.1) 0.96 Kwon, 2022[20] (CNN+LSTM) 36 (6, 9, 8, 11) 6.5~8.0 GHz UWB PSG –2.0 (–14.6, +10.7) 0.97 Hayano, 2020[42] (ACAT) 41 (11, 8, 16, 6) PPG PSG – 0.81 本文方法(雷达+脉搏波) 86 (27, 19, 14, 26) 60~63 GHz FMCW+PPG PSG 1.38 (–7.18, +9.94) 0.93 表 6 对照实验结果
Table 6. The results of control experiment
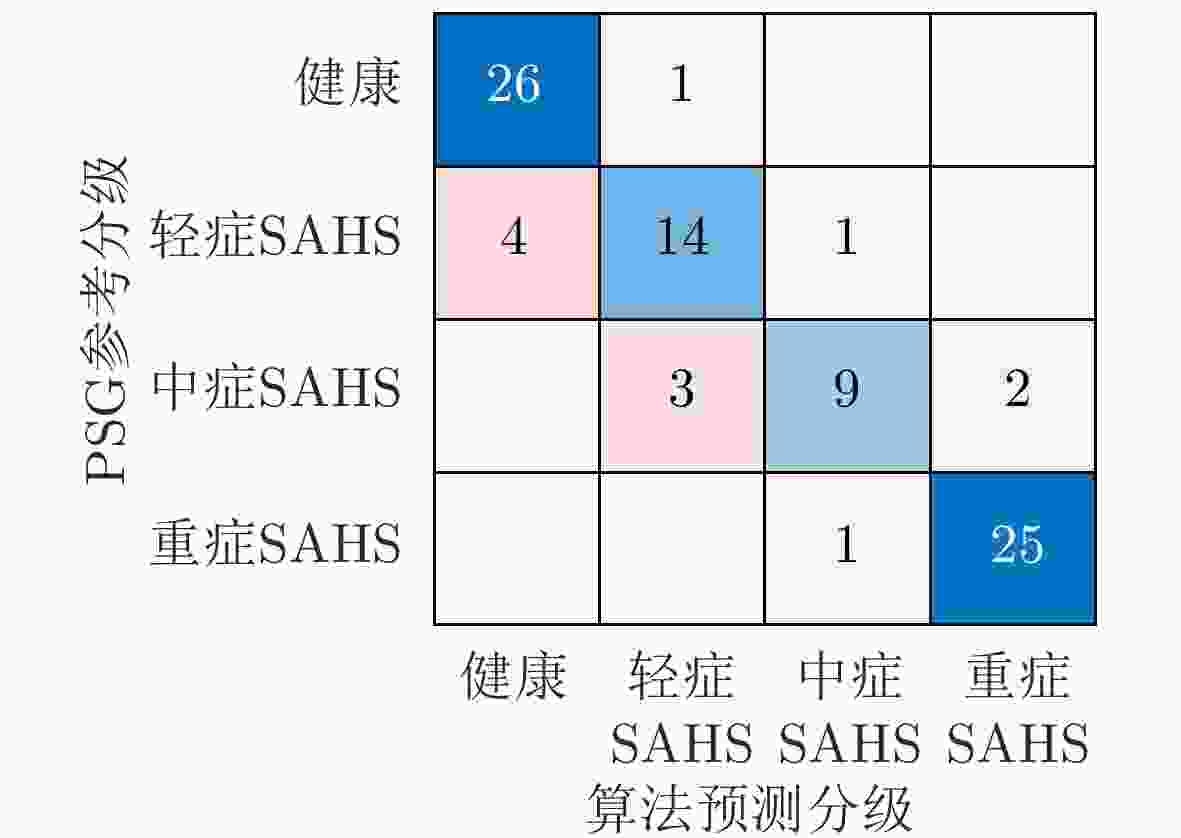
传感器 组内相关系数 诊断阈值(次/h) 敏感度(%) 特异度(%) 准确率(%) Kappa系数 PPG 0.89 5 74.07 89.83 84.88 0.6455 15 89.13 90.00 89.53 0.7901 30 95.00 80.77 90.69 0.7746 Radar 0.93 5 66.67 89.83 82.56 0.5825 15 91.30 92.50 91.86 0.8367 30 95.00 88.46 93.02 0.8346 Radar+PPG 0.98 5 96.29 93.22 94.19 0.8690 15 97.83 92.50 95.35 0.9062 30 96.67 96.15 96.51 0.9182 注:加粗项表示最优结果。 -
[1] JORDAN A S, MCSHARRY D G, and MALHOTRA A. Adult obstructive sleep apnoea[J]. The Lancet, 2014, 383(9918): 736–747. doi: 10.1016/S0140-6736(13)60734-5. [2] YOUNG T, PALTA M, DEMPSEY J, et al. The occurrence of sleep-disordered breathing among middle-aged adults[J]. New England Journal of Medicine, 1993, 328(17): 1230–1235. doi: 10.1056/NEJM199304293281704. [3] COWAN D C, ALLARDICE G, MACFARLANE D, et al. Predicting sleep disordered breathing in outpatients with suspected OSA[J]. BMJ Open, 2014, 4(4): e004519. doi: 10.1136/bmjopen-2013-004519. [4] RANDERATH W, VERBRAECKEN J, ANDREAS S, et al. Definition, discrimination, diagnosis and treatment of central breathing disturbances during sleep[J]. European Respiratory Journal, 2017, 49(1): 1600959. doi: 10.1183/13993003.00959-2016. [5] DONOVAN L M and KAPUR V K. Prevalence and characteristics of central compared to obstructive sleep apnea: Analyses from the sleep heart health study cohort[J]. Sleep, 2016, 39(7): 1353–1359. doi: 10.5665/sleep.5962. [6] BERRY R B, BROOKS R, GAMALDO C E, et al. The AASM manual for the scoring of sleep and associated events: Rules, terminology and technical specifications[R]. Version 2.0, 2012. [7] MCNAMES J N and FRASER A M. Obstructive sleep apnea classification based on spectrogram patterns in the electrocardiogram[C]. Computers in Cardiology 2000, Cambridge, USA, 2000: 749–752. doi: 10.1109/CIC.2000.898633. [8] TİMUŞ O H and BOLAT E D. k-NN-based classification of sleep apnea types using ECG[J]. Turkish Journal of Electrical Engineering and Computer Sciences, 2017, 25(4): 38. doi: 10.3906/elk-1511-99. [9] KARMAKAR C, KHANDOKER A, PENZEL T, et al. Detection of respiratory arousals using photoplethysmography (PPG) signal in sleep apnea patients[J]. IEEE Journal of Biomedical and Health Informatics, 2014, 18(3): 1065–1073. doi: 10.1109/JBHI.2013.2282338. [10] LAZAZZERA R, DEVIAENE M, VARON C, et al. Detection and classification of sleep apnea and hypopnea using PPG and SpO2 signals[J]. IEEE Transactions on Biomedical Engineering, 2021, 68(5): 1496–1506. doi: 10.1109/TBME.2020.3028041. [11] SHARMA M, KUMBHANI D, TIWARI J, et al. Automated detection of obstructive sleep apnea in more than 8000 subjects using frequency optimized orthogonal wavelet filter bank with respiratory and oximetry signals[J]. Computers in Biology and Medicine, 2022, 144: 105364. doi: 10.1016/j.compbiomed.2022.105364. [12] TARAN S and BAJAJ V. Sleep apnea detection using artificial bee colony optimize Hermite basis functions for EEG signals[J]. IEEE Transactions on Instrumentation and Measurement, 2020, 69(2): 608–616. doi: 10.1109/TIM.2019.2902809. [13] PAPINI G B, FONSECA P, VAN GILST M M, et al. Wearable monitoring of sleep-disordered breathing: Estimation of the apnea-hypopnea index using wrist-worn reflective photoplethysmography[J]. Scientific Reports, 2020, 10(1): 13512. doi: 10.1038/s41598-020-69935-7. [14] ZOU Lang and LIU Guanzheng. Multiscale bidirectional temporal convolutional network for sleep apnea detection based on wearable photoplethysmography bracelet[J]. IEEE Journal of Biomedical and Health Informatics, 2024, 28(3): 1331–1340. doi: 10.1109/JBHI.2023.3335658. [15] ZHOU Yong, SHU Degui, XU Hangdi, et al. Validation of novel automatic ultra-wideband radar for sleep apnea detection[J]. Journal of Thoracic Disease, 2020, 12(4): 1286–1295. doi: 10.21037/jtd.2020.02.59. [16] KAGAWA M, TOJIMA H, and MATSUI T. Non-contact diagnostic system for sleep apnea-hypopnea syndrome based on amplitude and phase analysis of thoracic and abdominal Doppler radars[J]. Medical & Biological Engineering & Computing, 2016, 54: 789–798. doi: 10.1007/s11517-015-1370-z. [17] LEE Y S, PATHIRANA P N, STEINFORT C L, et al. Monitoring and analysis of respiratory patterns using microwave Doppler radar[J]. IEEE Journal of Translational Engineering in Health and Medicine, 2014, 2: 1800912. doi: 10.1109/JTEHM.2014.2365776. [18] KANG Sun, KIM D K, LEE Y, et al. Non-contact diagnosis of obstructive sleep apnea using impulse-radio ultra-wideband radar[J]. Scientific Reports, 2020, 10(1): 5261. doi: 10.1038/s41598-020-62061-4. [19] ZAKRZEWSKI M, VEHKAOJA A, JOUTSEN A S, et al. Noncontact respiration monitoring during sleep with microwave Doppler radar[J]. IEEE Sensors Journal, 2015, 15(10): 5683–5693. doi: 10.1109/JSEN.2015.2446616. [20] KWON H B, SON D, LEE D, et al. Hybrid CNN-LSTM network for real-time apnea-hypopnea event detection based on IR-UWB Radar[J]. IEEE Access, 2022, 10: 17556–17564. doi: 10.1109/ACCESS.2021.3081747. [21] 潘虹, 黄国平, 任蓉, 等. 光电容积脉搏波描记法对阻塞性睡眠呼吸暂停综合征的诊断价值[J]. 中华医学杂志, 2016, 96(19): 1527–1529. doi: 10.3760/cma.j.issn.0376-2491.2016.19.014.PAN Hong, HUANG Guoping, REN Rong, et al. Diagnosis of obstructive sleep apnea syndrome using pulse oximeter derived photoplethysmographic signals[J]. National Medical Journal of China, 2016, 96(19): 1527–1529. doi: 10.3760/cma.j.issn.0376-2491.2016.19.014. [22] CHOI J W, KIM D H, KOO D L, et al. Automated detection of sleep apnea-hypopnea events based on 60 GHz frequency-modulated continuous-wave radar using convolutional recurrent neural networks: A preliminary report of a prospective cohort study[J]. Sensors, 2022, 22(19): 7177. doi: 10.3390/s22197177. [23] 余辉, 王硕, 李心蕊, 等. 基于LSTM-CNN的睡眠呼吸暂停与低通气事件实时检测算法研究[J]. 中国生物医学工程学报, 2020, 39(3): 303–310. doi: 10.3969/j.issn.0258-8021.2020.03.07.YU Hui, WANG Shuo, LI Xinrui, et al. Algorithm study of real-time detection of sleep apnea-hypopnea event based on long-short term memory-convolutional neural network[J]. Chinese Journal of Biomedical Engineering, 2020, 39(3): 303–310. doi: 10.3969/j.issn.0258-8021.2020.03.07. [24] TOFTEN S, KJELLSTADLI J T, TYVOLD S S, et al. A pilot study of detecting individual sleep apnea events using noncontact radar technology, pulse oximetry, and machine learning[J]. Journal of Sensors, 2021, 2021: 2998202. doi: 10.1155/2021/2998202. [25] 方震, 简璞, 张浩, 等. 基于FMCW雷达的非接触式医疗健康监测技术综述[J]. 雷达学报, 2022, 11(3): 499–516. doi: 10.12000/JR22019.FANG Zhen, JIAN Pu, ZHANG Hao, et al. Review of noncontact medical and health monitoring technologies based on FMCW Radar[J]. Journal of Radars, 2022, 11(3): 499–516. doi: 10.12000/JR22019. [26] JAVAID A Q, NOBLE C M, ROSENBERG R, et al. Towards sleep apnea screening with an under-the-mattress IR-UWB radar using machine learning[C]. The 14th IEEE International Conference on Machine Learning And Applications (ICMLA), Miami, USA, 2015: 837–842. doi: 10.1109/ICMLA.2015.79. [27] BHOWMIK T, DEY J, and TIWARI V N. A novel method for accurate estimation of HRV from smartwatch PPG signals[C]. The 39th Annual International Conference of the IEEE Engineering in Medicine and Biology society (EMBC), Jeju, Korea (South), 2017: 109–112. doi: 10.1109/EMBC.2017.8036774. [28] ELGENDI M, FLETCHER R, LIANG Yongbo, et al. The use of photoplethysmography for assessing hypertension[J]. NPJ Digital Medicine, 2019, 2(1): 60. doi: 10.1038/s41746-019-0136-7. [29] THOMAS R J. Arousals in sleep-disordered breathing: Patterns and implications[J]. Sleep, 2003, 26(8): 1042–1047. doi: 10.1093/sleep/26.8.1042. [30] ISSA F G and SULLIVAN C E. Arousal and breathing responses to airway occlusion in healthy sleeping adults[J]. Journal of Applied Physiology, 1983, 55(4): 1113–1119. doi: 10.1152/jappl.1983.55.4.1113. [31] HU Jie, SHEN Li, and SUN Gang. Squeeze-and-excitation networks[C]. 2018 IEEE/CVF Conference on Computer Vision and Pattern Recognition, Salt Lake City, USA, 2018: 7132–7141. doi: 10.1109/CVPR.2018.00745. [32] WANG C Y, BOCHKOVSKIY A, and LIAO H Y M. Scaled-YOLOv4: Scaling cross stage partial network[C]. 2021 IEEE/CVF Conference on Computer Vision and Pattern Recognition, Nashville, USA, 2021: 13024–13033. doi: 10.1109/CVPR46437.2021.01283. [33] PERSLEV M, JENSEN M H, DARKNER S, et al. U-Time: A fully convolutional network for time series segmentation applied to sleep staging[C]. The 33rd International Conference on Neural Information Processing Systems, Vancouver, Canada, 2019: 397. [34] LIN T Y, GOYAL P, GIRSHICK R, et al. Focal loss for dense object detection[C]. 2017 IEEE International Conference on Computer Vision, Venice, Italy, 2017: 2999–3007. doi: 10.1109/ICCV.2017.324. [35] MILLETARI F, NAVAB N, and AHMADI S A. V-Net: Fully convolutional neural networks for volumetric medical image segmentation[C]. The Fourth International Conference on 3D Vision (3DV), Stanford, USA, 2016: 565–571. doi: 10.1109/3DV.2016.79. [36] SNEATH P H A. The principles and practice of numerical classification[J]. Numerical Taxonomy, 1973, 573. [37] LOSHCHILOV I and HUTTER F. Decoupled weight decay regularization[C]. The 7th International Conference on Learning Representations, New Orleans, USA, 2019. [38] VAN DER MAATEN L and HINTON G. Visualizing data using t-SNE[J]. Journal of Machine Learning Research, 2008, 9(86): 2579–2605. [39] BLAND J M and ALTMAN D G. Agreed statistics: Measurement method comparison[J]. Anesthesiology, 2012, 116(1): 182–185. doi: 10.1097/ALN.0b013e31823d7784. [40] SEDGWICK P. Pearson’s correlation coefficient[J]. BMJ, 2012, 345: e4483. doi: 10.1136/bmj.e4483. [41] GIAVARINA D. Understanding bland Altman analysis[J]. Biochemia Medica, 2015, 25(2): 141–151. doi: 10.11613/BM.2015.015. [42] HAYANO J, YAMAMOTO H, NONAKA I, et al. Quantitative detection of sleep apnea with wearable watch device[J]. PLoS One, 2020, 15(11): e0237279. doi: 10.1371/journal.pone.0237279. [43] SENARATNA C V, PERRET J L, LODGE C J, et al. Prevalence of obstructive sleep apnea in the general population: A systematic review[J]. Sleep Medicine Reviews, 2017, 34: 70–81. doi: 10.1016/j.smrv.2016.07.002. -


 作者中心
作者中心 专家审稿
专家审稿 责编办公
责编办公 编辑办公
编辑办公
 下载:
下载: